Cara Paling Mudah Menentukan Bentuk Molekul Ion Poliatomik Serba Ada
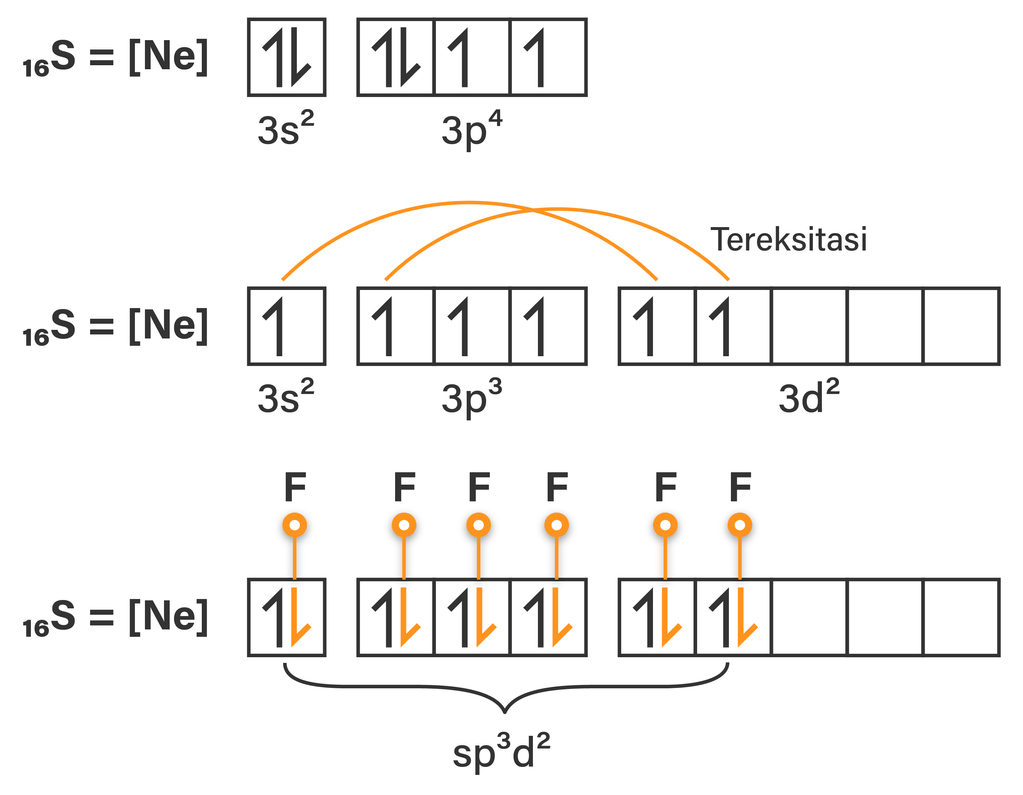
S {-6+6} + 6 (F {-1+1}) ⇒ SF 6. Hibridisasi Atom S, Bentuk Molekul, dan Kepolaran SF2. Detil yang khusus membahas tentang hibridisasi, bentuk molekul, dan kepolaran senyawa silakan disimak di sini. Bentuk dasar (geometri elektron, semua pasangan elektron diperhatikan) SF 2 adalah tetrahedral. Bentuk molekul (geometri molekul, hanya.
SF6 Sulfur hexafluoride
Teori Bentuk Molekul. 1. Teori VSEPR. Bunyi teori VSEPR adalah pasangan elektron dalam ikatan kimia ataupun pasangan elektron yang tidak dipakai bersama (yaitu pasangan elektron "mandiri") saling tolak-menolak, pasangan elektron cenderung untuk berjauhan satu sama lain.
SF6分子幾何学、ルイス構造、形状、および極性 Peaceful Place
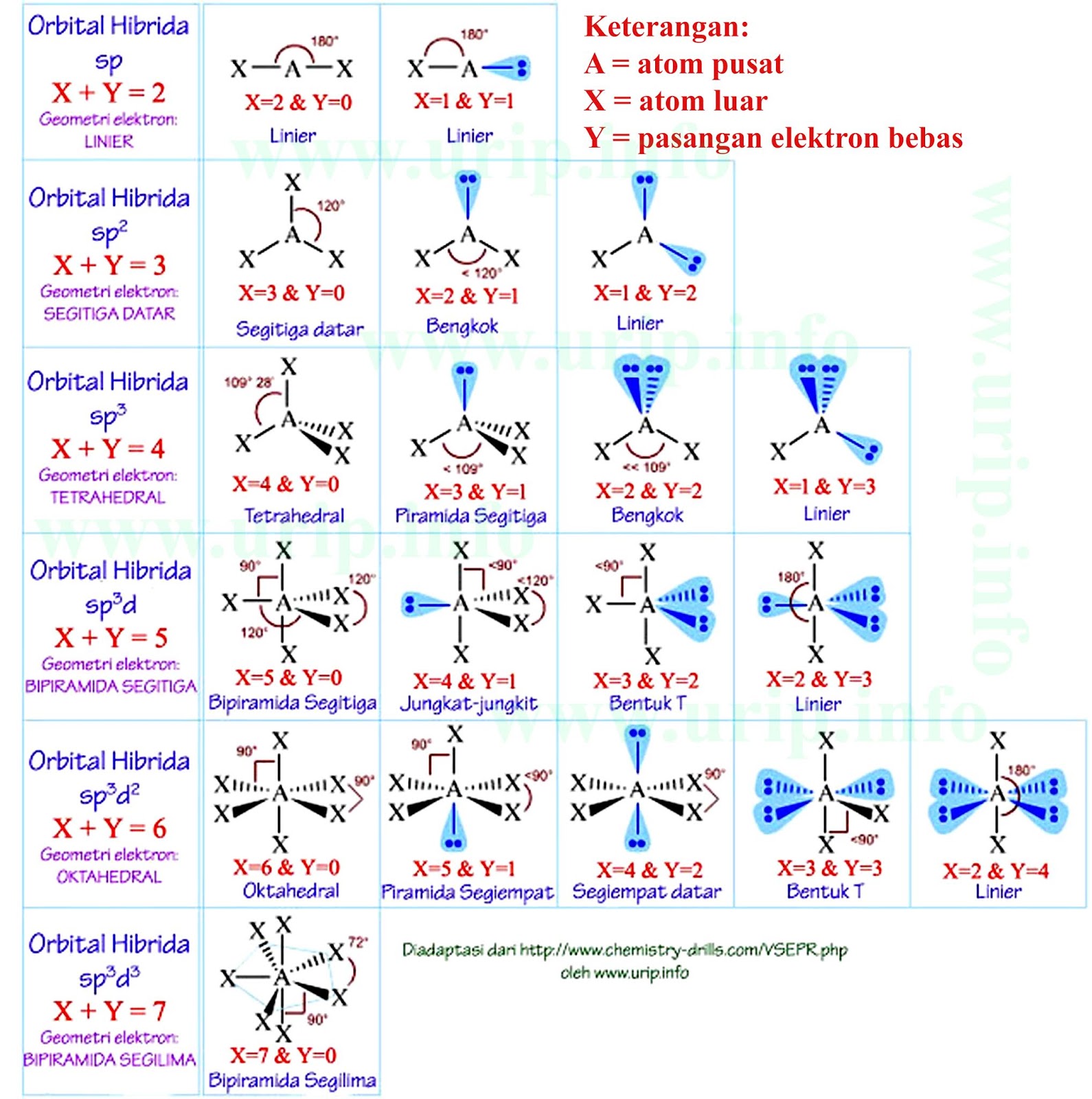
Rumus notasi VSEPR. Notasi VSEPR menentukan bentuk molekul melalui rumus umum yang memperhitungkan jumlah pasangan elektron pada atom. Berikut adalah rumus notasi VSEPR: A: atom pusat. X: Elektron terikat. a: jumlah pasangan elektron ikatan (PEI) yang terikat pada atom pusat. E: kelompok elektron valensi non-ikatan (PEB)
jelaskan proses hibridisasi molekul SF6...
Contohnya adalah molekul oksigen (O2), yang terdiri dari. Contoh: SF6. Bentuk senyawa molekular dapat mempengaruhi sifat-sifat kimia dan fisik senyawa, seperti kelarutan, titik didih, dan polaritas. Selain itu, bentuk molekul juga berperan penting dalam menentukan reaktivitas senyawa dan bagaimana senyawa tersebut berinteraksi dengan senyawa.

SF6 Lewis Structure, Molecular Geometry, Hybridization, and MO Diagram Techiescientist
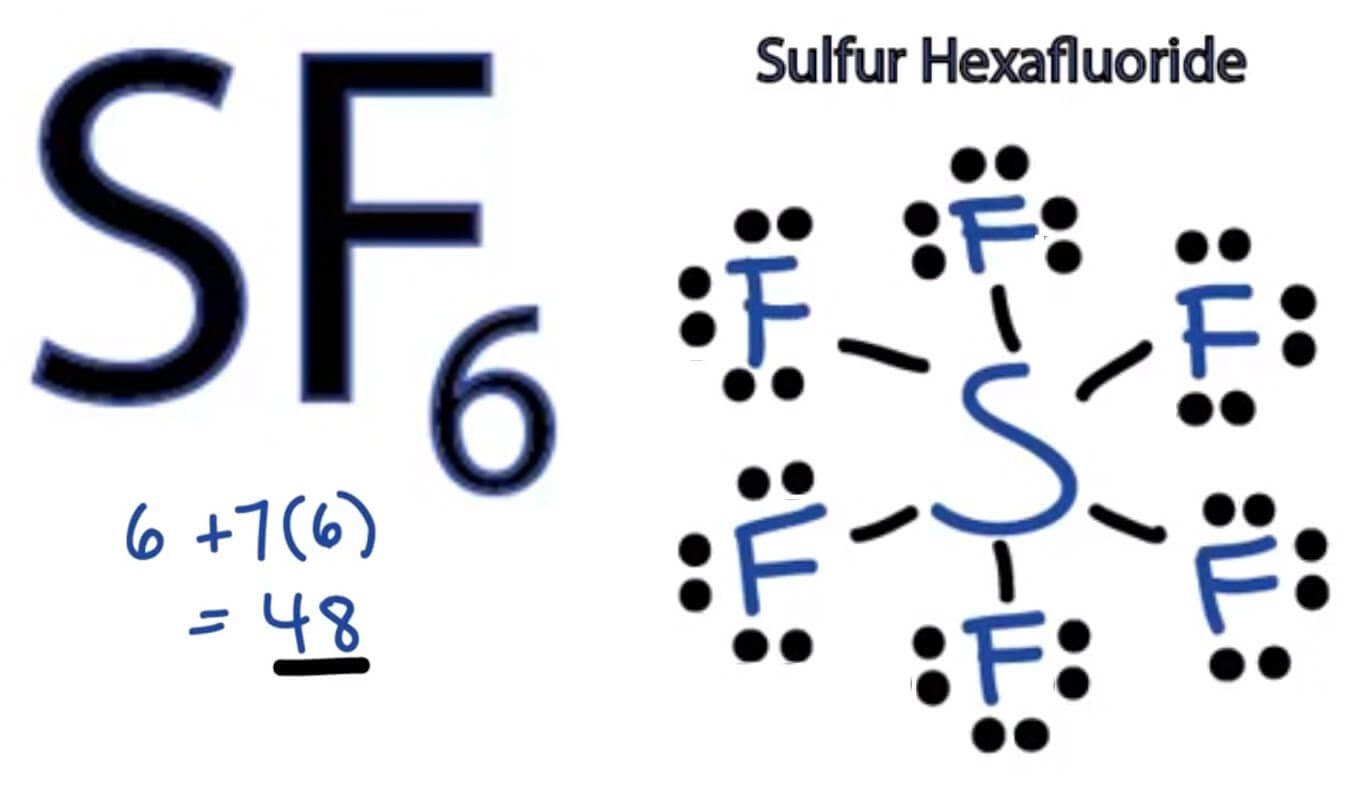
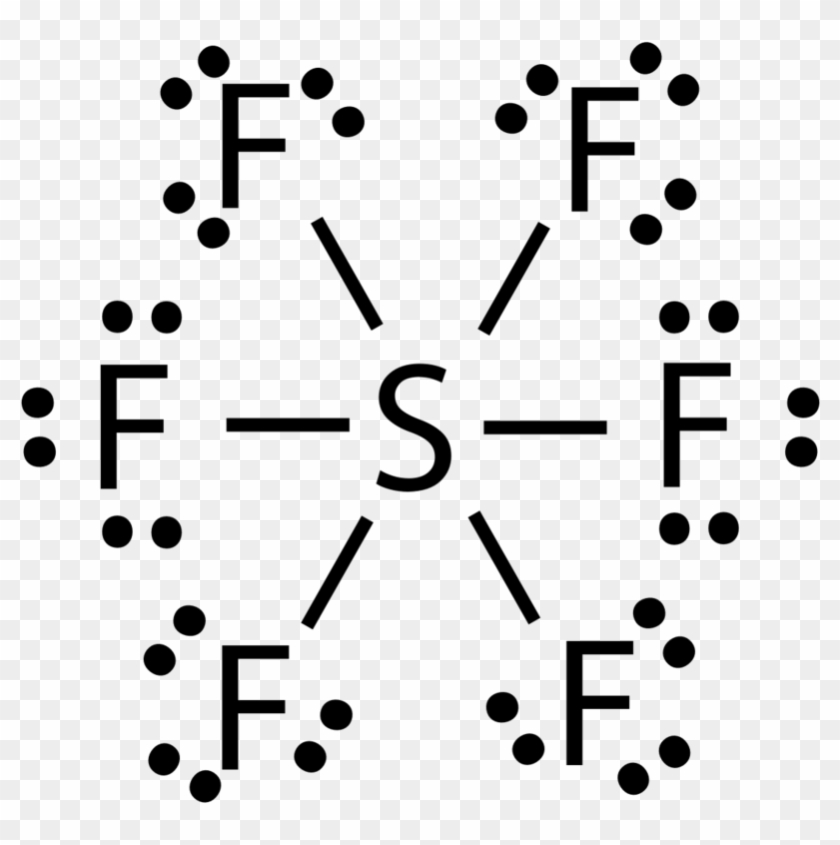
Langkah 1: Temukan jumlah total elektron valensi dalam molekul SF6. Untuk mengetahui jumlah total elektron valensi dalam molekul SF6 (sulfur heksafluorida), pertama-tama Anda perlu mengetahui elektron valensi yang ada dalam atom belerang dan juga atom fluor. (Elektron valensi adalah elektron yang ada di orbit terluar atom mana pun.)

The skeleton of SF6 molecules. The vector potentials of the twocolor Download Scientific Diagram
H C + 4 H H C H H f GEOMETRI/BENTUK MOLEKUL Bentuk molekul ditentukan melalui percobaan, namun demikian dapat pula diramalkan berdasarkan pemahaman struktur elektron dalam molekul itu. Teori Domain Elektron Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron disekitar atom pusat. Jumlah domain elektron ditentukan sbb: 1.
Sf6 lewis structure
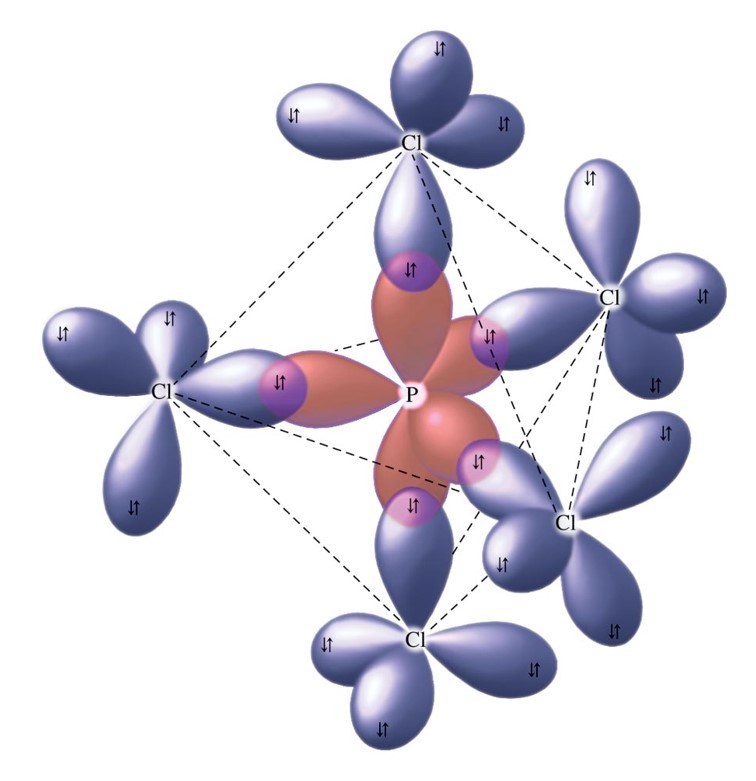
Bentuk molekul CH4 adalah tetrahedral, sama seperti struktur orbital hibrida sp3 (lihat Gambar 2.15).. Contoh molekul dengan bentuk trigonal bipiramidal adalah PCl5 dan contoh molekul oktahedral adalah SF6 . Tinjau molekul PCl5 dengan atom P sebagai atom pusat. Konfigurasi elektronnya: 15P: 1s2 2s2 2p6 3s2 3p3 3d0 . Hibridisasi satu orbital.

Pasangan Gambar Yang Merupakan Molekul Senyawa Adalah denah
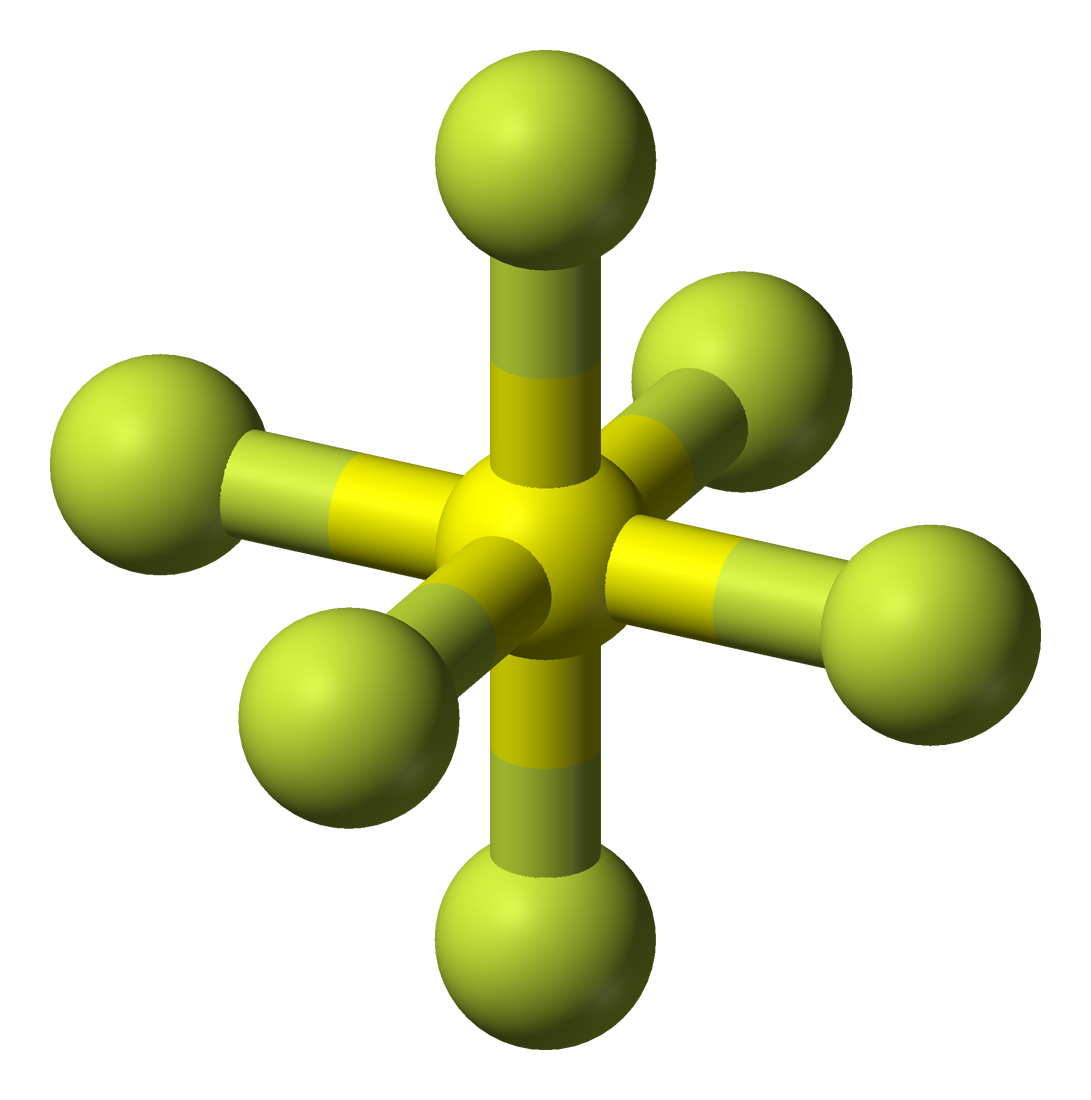
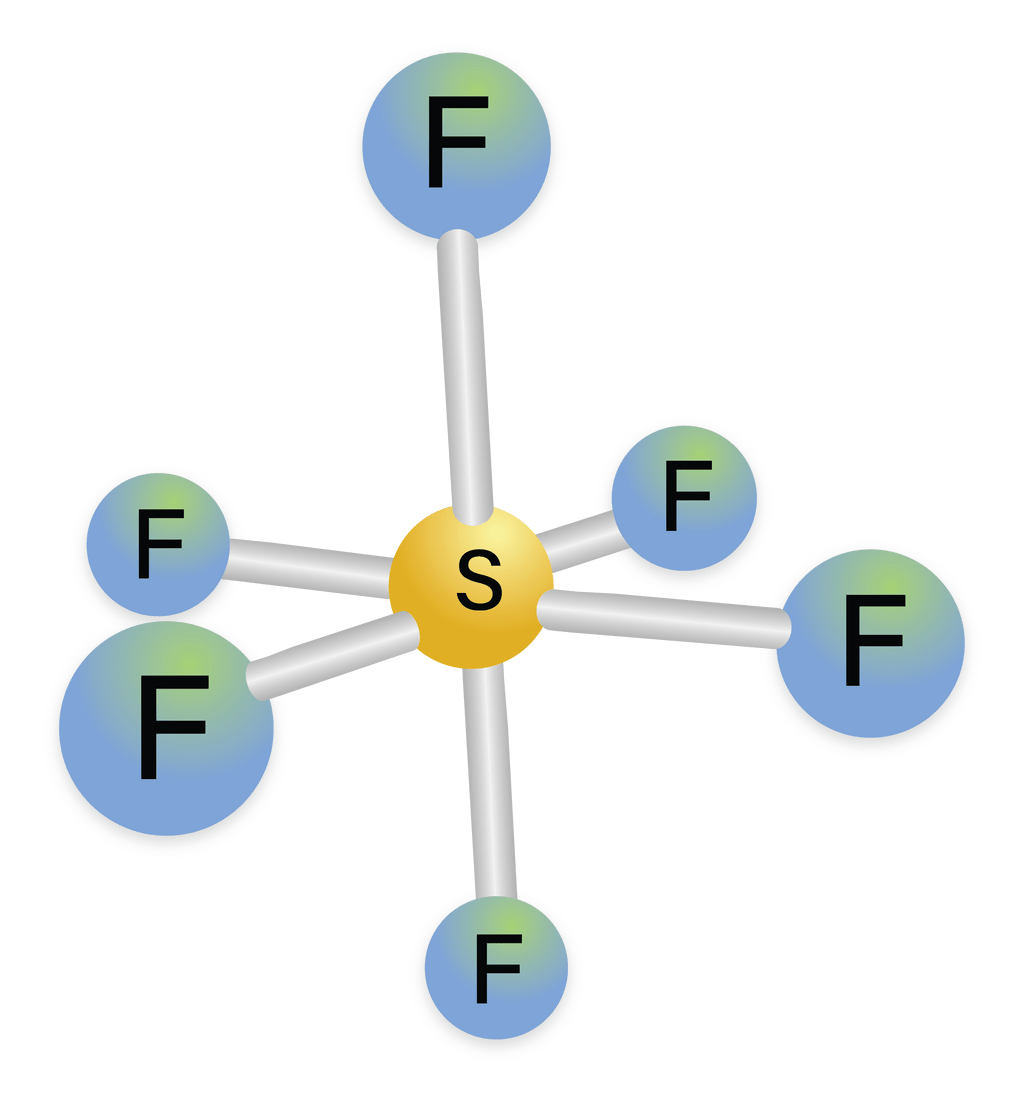
Pada terdapat 1 atom S dan 6 atom F. Langkah penentuan bentuk molekul adalah sebagai berikut.. Menentukan elektron valensi dengan 6 elektron valensi dengan 7 elektron valensi; Menentukan bentuk mokelul Senyawa memiliki 6 buah pasang elektron ikatan dan tidak memiliki pasangan elektron bebas, sehingga bentuk geometri molekulnya adalah oktahedron.; Jadi, jawaban yang tepat adalah E.
Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi Anto Tunggal
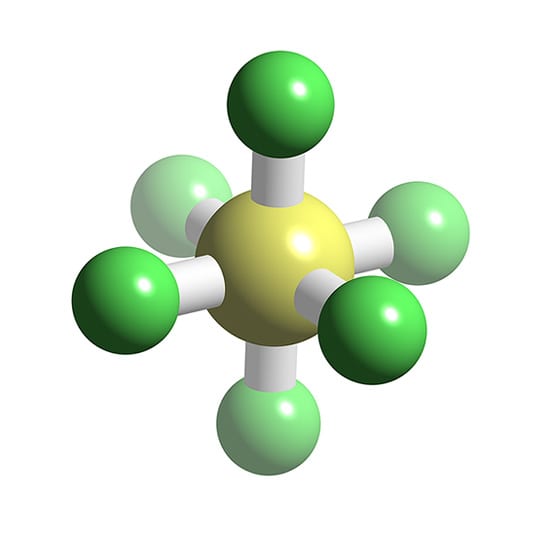
Belerang heksafluorida (SF 6) adalah suatu gas anorganik yang tidak berwarna, tidak berbau, tidak mudah terbakar, dan sangat berpotensi merupakan gas rumah kaca, yang mana ia merupakan insulator listrik yang baik. [4] SF6 memiliki geometri molekul oktahedral, terdiri dari enam atom fluor yang menempel pada atom pusat belerang.

SF6 Lewis Structure, Molecular Geometry, Hybridization, and MO Diagram Techiescientist
Sedangkan PEB dapat ditentukan dengan rumus yaitu: Maka memilikiPEI = 4, dan atom pusat S merupakan golongan VIA artinya ev = 6, maka: Dengan demikian maka jumlah domain elektron adalah 5(4 PEI+1 PEB), sehingga bentuk dasar senyawanya adalah segitiga bipiramida. karena ada nya PEB maka bentuk molekul nya akan berubah menjadi: Dengan demikian.
Bentuk Molekul SF6 MateriKimia
Pengertian geometri molekul adalah susunan ruang atom-atom dalam molekul. Pengertian hibridisasi adalah suatu konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru dalam pembentukan ikatan. Konsep ini berfungsi menjelaskan terjadinya bentuk/geometri molekul. Teori VSEPR (Valence Shell Electron Pair Repulsion)
Drawn Molecule Sf6 Sf6 Lewis Dot Structure Free Transparent PNG Clipart Images Download
Molekul PCl 5 adalah bentuk bipiramida trigonal.. SF6, BeCl2 dan beragam bentuk molekul lainya. Klik banner di bawah ya! Sekian materi tentang hibridisasi molekul dari gue, semoga dengan membaca artikel ini elo jadi lebih paham dan bisa mendapat nilai maksimal ketika ujian.
Tentukan jumlah pasangan elektron terikat, jumlah
SF6. 2. Menentukan hibridisasi dengan cara SUPER "Solusi Quipper" a. BeCl2. b. SF6. Contoh soal 1. Contoh soal 2. Bentuk Molekul. Bentuk molekul adalah susunan atom-atom di dalam molekul dalam bentuk tiga dimensi. Siapa sangka jika bentuk molekul inilah yang menyebabkan perbedaan sifat fisis dan kimia suatu senyawa, misalnya titik leleh.

BENTUK MOLEKUL SENYAWA VSEPR dan HIBRIDISASI YouTube
Nah, kemudian dia akan berikatan dengan CL yang jumlahnya ada 5 yang berwarna merah itu adalah pasangan elektron ikatan jumlahnya adalah dan pb-nya 0 karena semua elektron yang ada di P sudah berpasangan kita dapatkan rumusnya adalah a ax5 Sekarang kita akan menentukan bentuk molekulnya untuk sf6 tadi rumusnya itu adalah a x 6 untuk si ccl4.

molekul SF6 by Eliyana Hasifu 3D model by asetilenaa [951b521] Sketchfab
Sehingga tipe molekul adalah AX 2 E 2 (bentuk V) senyawa : konfigurasi atom pusat 15 P = 2, 8, 5 . PEI = 5. Sehingga tipe molekul adalah AX 5 (bipiramida trigonal) Jadi, senyawa 1 = oktahedral, senyawa 2 = tetrahedral, senyawa 3 = bentuk V, senyawa 4 = bipiramida trigonal.
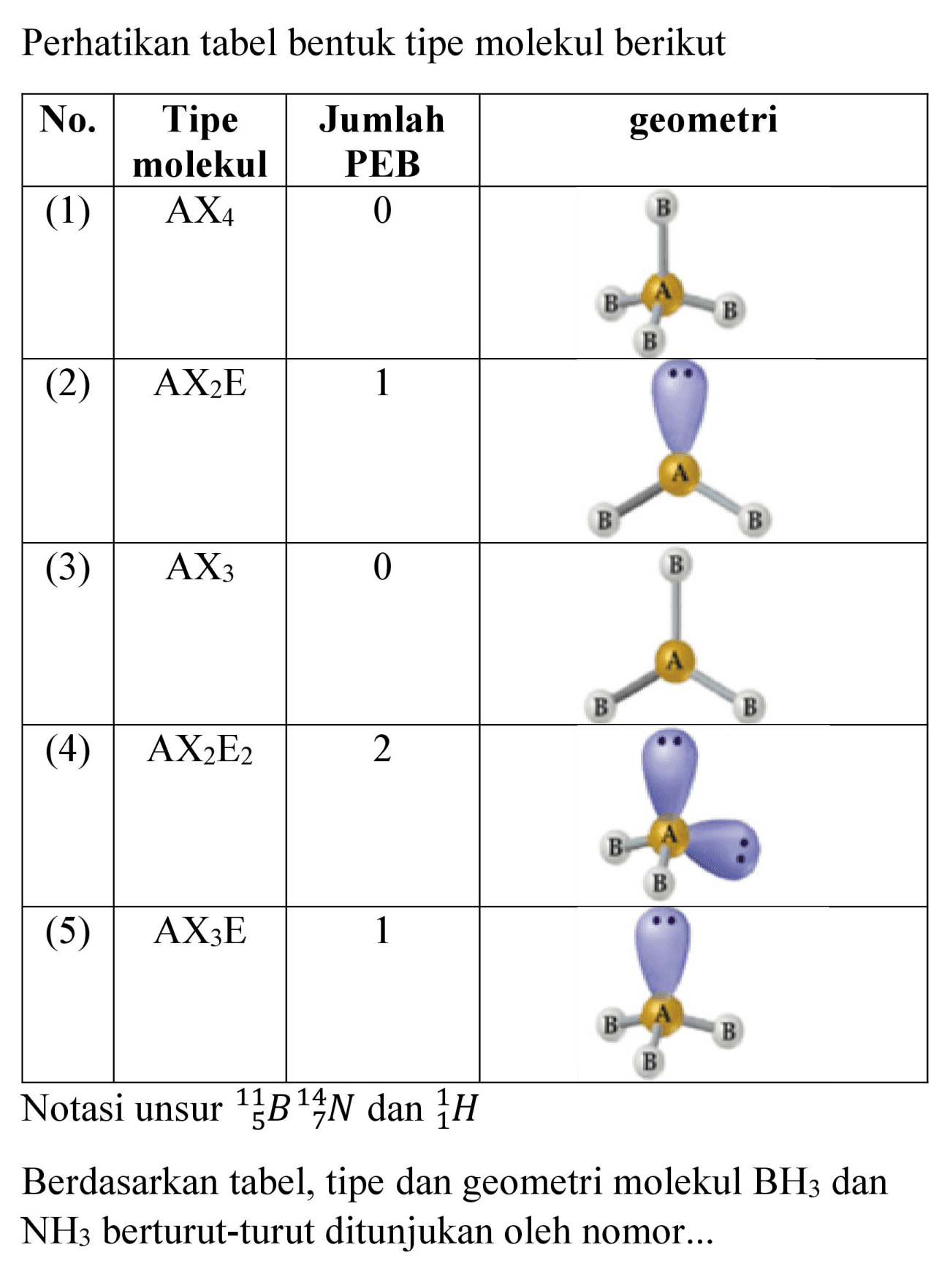
Ramalkan bentuk molekulmolekul di bawah ini dengan mengg...
Molekul ini umumnya nonpolar karena bentuknya yang sangat simetris. Sudut ikatan dalam bentuk molekul octahedral terdiri dari sudut-sudut tertentu yang tetap. Contoh umum dari molekul dengan bentuk octahedral adalah sulfur heksafluorida (SF6). Dalam molekul SF6, terdapat satu atom sulfur (S) yang terikat secara kovalen dengan enam atom fluor (F).